Литий-ионные аккумуляторы встречаются в современной технике на каждом шагу и весьма быстро совершенствуются, но их свойства продолжают оставаться далекими от желаемых.
Напомню принцип работы литий-ионного аккумулятора. При зарядке происходят следующие процессы: перенос ионов Li+ от катода к аноду через электролит и электрохимические реакции на электродах:
на катоде: LiCoO2 → Li1-xCoO2 + xLi+ + xe−
на аноде: С + xLi+ + xe− → CLix
При разрядке все процессы идут в обратном направлении.
Исследователи стараются улучшить все компоненты аккумулятора, но для повышения его емкости особое внимание уделяют электродам, стараясь повысить их удельную способность к аккумуляции ионов лития, стремятся также повысить их проводимость и стабильность. На эти темы регулярно появляются заметки в Нанометре, причем как о катодах (предлагается замещение LiCoO2 на LiFePO4), так и об анодах (предлагается замена углеродного анода кремниевым, способным поглотить большее число ионов лития на единицу собственной массы).
Здесь я хочу сообщить об инновационном аноде из полых нанотрубок оксида железа, разработанном на замену традиционных графитовых. Идея использования массива нанотрубок в качестве анода уже возникала и обсуждалась Нанометром, но тогда речь шла о нанонитях оксида олова.
α-Fe2O3 состоит из гексагональной плотнейшей упаковки анионов кислорода и катионов Fe3+ в 2/3 октаэдрических пустот структуры. Еще треть октаэдрических пустот может быть заполнена при зарядке катионами лития, при этом часть железа восстановится до степени окисления +2:
α-Fe2O3 + Li+ + e− → LiFe2O3
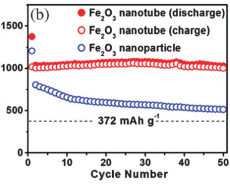
Подобный электрод обеспечивает емкость до 1000 мА*ч/г при условии полной зарядки/разрядки за 2 часа и 500-800 мА*ч/г при ускорении процессов в 2-4 раза. Это значительно превосходит емкость графитовых электродов (372 мА*ч/г) и приближается к емкости электродов на основе нанотрубок оксида олова (1900 мА*ч/г), примерно на порядок превосходя их по скорости зарядки/разрядки.
А производят описанные электроды по весьма оригинальной методике. Сначала формируют массив нанонитей меди. Затем осаждают на их поверхность FeCl2 с образованием CuCl из меди и его растворением:
Cu + FeCl3 → CuCl(тв) + FeCl2
CuCl + Cl- → CuCl2-(раств)
Адсорбированные на растворяющейся поверхности меди ионы Fe2+ Fe3+ быстро гидролизуются, формируя смешанный гидроксид Fe(OH)x в виде полых нанотрубок. После завершения вышеописанных процессов полученный массив нанотрубок подвергается окислительному отжигу для дегидротации и перевода всего железа в степень окисления +3.